Ποιες είναι οι κύριες ιδιότητες των οξειδίων;

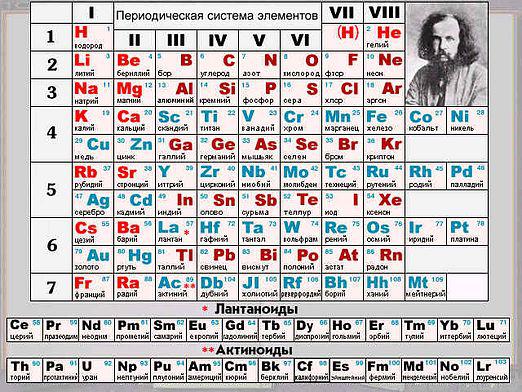
Από το σχολικό πρόγραμμα χημείας σε καθένα από εμάςείναι γνωστό με βεβαιότητα ότι τα οξείδια είναι μάλλον πολύπλοκες χημικές ουσίες, οι οποίες είναι ενώσεις αρκετά απλών στοιχείων με ένα αέριο όπως το οξυγόνο. Υπάρχουν οξείδια και οξείδια που σχηματίζουν άλατα και δεν σχηματίζουν αλάτι. Τα πρώτα διαιρούνται σε τρεις κατηγορίες: όξινα, βασικά και αμφοτερικά. Ας δούμε τις χημικές ιδιότητες των οξειδίων.
Βασικά οξείδια
Σε αυτό το είδος των οξειδίων είναι πολύπλοκεςχημικές ουσίες που είναι ικανές να σχηματίζουν άλατα κατά την αντίδραση με οξέα ή οξείδια, αλλά δεν αντιδρούν με βασικά οξείδια ή βάσεις. Για παράδειγμα, τα ακόλουθα είναι τα κύρια οξείδια: οξείδιο του καλίου, οξείδιο του ασβεστίου, οξείδιο του σιδήρου.
Τώρα, ας πάρουμε ένα παράδειγμα των ιδιοτήτων του βασικού οξειδίου.
1. Αντίδραση με νερό. Εισαγωγή της αλληλεπίδρασης στο Η2Ω, το βασικό οξείδιο σχηματίζει αλκάλια. Για παράδειγμα, η αντίδραση του ασβέστου σβέσης. CaO + Η2Ο = Ca (ΟΗ)2.
2. Αντίδραση με οξέα. Με αντίδραση με οξέα, σχηματίζονται νερό και άλατα, για παράδειγμα CaO + H2Έτσι4 = CaSO4+ Η2Ο.
3. Αντίδραση με όξινα οξείδια. Όταν αλληλεπιδρά με όξινα οξείδια, σχηματίζεται άλας. Για παράδειγμα, CaO + CO2= CaCO3 - τύπος εκπαίδευσης κιμωλία.
Οξικά οξέα
Αυτή είναι η λεγόμενη πολύπλοκη χημική ουσίαουσίες που αναφέρονται σε οξείδια και αλληλεπιδρούν με βασικά οξείδια ή βάσεις, σχηματίζουν άλατα. Ένα παράδειγμα είναι το διοξείδιο του άνθρακα CO2, τριοξείδιο του θείου Έτσι3. Οι ιδιότητες των οξειδίων είναι οι ακόλουθες:
-οξείδια του οξέος μπορούν να αντιδράσουν με νερό. Για παράδειγμα, με αυτόν τον τρόπο το ανθρακικό οξύ CO2+ Η2Ο = Η2CO3 .
- με αλκάλια ή βάσεις. Ένα παράδειγμα είναι το ακόλουθο CO2+ ΝαΟΗ = Να2CO3. Ως αποτέλεσμα, δεν πρέπει να υπάρχει τίποτα άλλο παράπυρωμένο ή σόδα για πλύσιμο. Είναι ένα εξαιρετικό φάρμακο για την απομάκρυνση βρωμιών και λίπους από την επιφάνεια των τηγανιών. Επίσης με τη βοήθεια αυτού του εργαλείου, μερικοί γαιοκτήμονες αφαιρούν τις καμένες περιοχές.
- αντίδραση με βασικά οξείδια. Παράδειγμα - CO2+ MgO = MgCO3, την παραγωγή ανθρακικού μαγνησίου.
Αμφοτερικά οξείδια
Τέτοια οξείδια καλούνται σύνθετα χημικάουσίες που μπορούν επίσης να αποδοθούν σε οξείδια που δεν σχηματίζουν τίποτα περισσότερο από άλατα στη διαδικασία χημικής αντίδρασης με οξέα ή βάσεις. Τις περισσότερες φορές είμαστε συνηθισμένοι να χρησιμοποιούμε τη λέξη "αμφοτερικό" όταν μιλάμε για μέταλλα. Εν μέρει αυτό είναι σωστό, διότι στην περίπτωση αυτή τα οξείδια ονομάζονται αμφοτερικά, διότι αντιδρούν με μέταλλα.
Ως παράδειγμα αμφοτερικού οξειδίου, το οξείδιο του ψευδαργύρου ZnO, το οποίο χρησιμοποιείται ευρέως στην ιατρική ή στο οξείδιο του αργιλίου Al2Ο3.
Οι κυριότερες ιδιότητες των οξειδίων που αντιδρούν με μέταλλα είναι ότι είναι σε θέση να αντιδρούν όχι μόνο με οξέα, αλλά και με βάσεις.
Ένα παράδειγμα είναι η αλληλεπίδραση ενός αμφοτερικού οξειδίου με ένα οξείδιο του οξυγόνου, το οποίο έχει σαν αποτέλεσμα το ZnO + H2CO3 = ZnCO3 + Η2Ο.
Κατά τον ίδιο τρόπο, λαμβάνεται επίσης διπλό άλας ψευδαργύρου και νατρίου. Τέτοιες αντιδράσεις συμβαίνουν συνήθως με αυξημένη απελευθέρωση ενέργειας.
Προκειμένου να κατανοηθεί η εμφάνιση αυτής ή εκείνης της αντίδρασης, δεν υπάρχει αρκετή περιγραφή, είναι απαραίτητο να το κάνετε μόνοι σας στο εργαστήριο.